Uhlovodíky I-alkany
Alkany, které se dříve nazývaly parafíny, jsou nasycené uhlovodíky (mají pouze jednoduché vazby). Ve své struktuře obsahují pouze atomy vodíku a uhlíku.
Hlavním zdrojem alkanů (do počtu uhlíku 40 ve struktuře) je ropa a zemní plyn. Zemní plyn je tvořen z 60% methanem. Ropa je složitější směsí uhlovodíků, které se z ní získávají rektifikací zhruba podle počtu uhlíků v molekule. Jelikož ropa a zemní plyn neobsahuje jednotlivé uhlovodíky v takových poměrech, jak to žádá spotřeba, upravují se tyto suroviny řadou technologických postupů. Protože uhlovodíky jsou nejjednoduššími organickými sloučeninami, tak je jejich názvosloví základem pro pojmenování složitějších sloučenin. Jejich obecný vzorec je CnH2n+2, kde n značí počet atomů uhlíku.
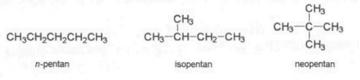
Mezi základních 10 alkanů patří methan (n=1), ethan (n=2), propan (n=3), butan (n=4), pentan (n=5), hexan (n=6), heptan (n=7), oktan (n=8) nonan (n=9), dekan (n=10). Toto názvosloví se nazývá systematické, ale kromě tohoto se u alkanů používá názvosloví s polosystematickými předponami n-, iso- a neo-, které však nelze navzájem kombinovat. Předpona n- znázorňuje lineární řetězec, iso- značí přítomnost jedné a předpona neo- dvou methylových skupin na druhém uhlíku řetězce.
Alkany se vyskytují ve všech skupenstvích za běžných podmínek. V kapalném skupenství jsou alkany s počtem uhlíků od 5 do 17. Ty, které mají menší počet uhlíků jsou plynné a ty s více uhlíky jsou bílé pevné látky. Body varu a tání postupně stoupají s přibývajícím počtem uhlíků. Body tání nerozvětvených alkanů jsou menší, než rozvětvených. Protože jsou to nepolární rozpouštědla, tak se nemísí s vodou, ale naopak se mísí navzájem. Nižší alkany jsou částečně rozpustné v ethanolu, ale jejich rozpustnost se s délkou řetězce snižuje. Všechny alkany jsou hořlavé a snadno zápalné.
Alkany jsou obecně látky velmi málo reaktivní, což je dáno velkou pevností vazeb. Ty se tedy štěpí buď vysokou teplotou nebo ultrafialovým zářením za vzniku radikálů. Tato reakce se nazývá radikálová substituce. Obecně se skládá ze tří kroků, které se nazývají iniciace (tvorba radikálů), propagace (obnovování a spojování radikálů) a terminace (konečné pospojování radikálů). Radikálová substituce nevede pouze na jeden produkt, ale vzniká směs produktů. S rostoucím počtem uhlíků ve struktuře roste také množství vznikajících produktů. Nyní se tedy konkrétně podíváme na jednotlivé důležité reakce.
Z alkanů můžou vznikat halogenderiváty halogenací. Halogeny se štěpí pomocí ultrafialového záření na radikály halogenu (X).
Další možnou reakcí je nitrace. Důkladně jsme si popis radikálové substituce ukázali na halogenaci, tak v případě nitrace popíšeme jednotlivé kroky pouze slovně. Nejdříve probíhá iniciace, která v tomto případě je vyvolána vysokou teplotou (425°C). Při této teplotě vzniká radikál tepelným rozkladem kyseliny dusičné nebo oxidu dusičitého. Ten v propagačním kroku atakuje alkan, čímž z něho vytváří radikál. V posledním terminačním kroku vzniká směs nitroalkanu. Nitroalkany se používají jako raketová paliva, rozpouštědla, či slouží jako sloučeniny pro další organickou syntézu.
Oxidace je v praxi nejvýznamnější reakcí alkanů, avšak nikoliv ze syntetického hlediska, ale pro uvolněnou tepelnou energii. Jedná se tedy o spalování alkanů (například benzínu v motoru) za vzniku sazí, vody a oxidu uhličitého. Řízenou oxidací se dají vyrobit směsi alkoholů, aldehydů, ketonů či karboxylových kyselin. Řízená oxidace navíc vyžaduje katalyzátor, kterým je nejčastěji sůl přechodových kovů (Mn2+, Co3+).
A kde se můžeme s alkany setkat? Na směsi propanu a butanu si můžeme uvařit jídlo, či se vyskytuje jako náplň zapalovače. Mezi nejznámější směs kapalných uhlovodíků patří benzín, či nafta, bez kterých bychom se dnes neobešli. A vyšší pevné alkany jsou součásti vosků rostlin, které je chrání.
Autor: Jaroslav Kocík, KocikJ@seznam.cz